

氧化还原电位滴定法
氧化还原(或氧化还原)反应涉及电子(或H或氢化物基团)从供体转移到受体。供体失去一个电子,从还原变为氧化形式; 受体获得电子,并从氧化形式变为还原形式。据说氧化还原组分的氧化和还原形式形成氧化还原对。
热力学中氧化还原反应的特殊兴趣在于可以使用电化学电池直接测量自由能变化(参见下图)。
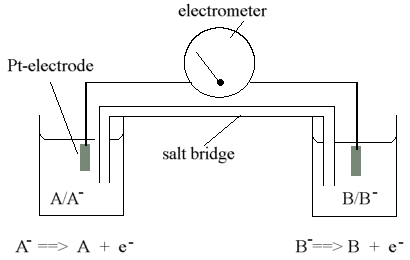
总体反应:
A - + B <===> A + B -
分离反应组分,使供体对和受体偶合在分开的反应容器中。容器通过盐桥连接,使得它们之间的静电势差为零。在每个容器中,电极(通常由Pt制成)通过测量装置(电位计或静电计)将一个电池中的反应混合物连接到另一个电池中的反应混合物。因此,电化学电池由两个半电池组成,每个半电池包含一个氧化还原对的反应物(氧化和还原组分),构成半电池反应物。原则上,该电路允许电子从一个半电池流向另一个半电池,沿着由两个半电池反应平衡的电子自由能差(以伏特为单位)提供的梯度向下流动。通过将该流引导通过测量装置,系统受到约束,使得通量为零(或非常接近)。如果使用电位计,则通过平衡两个半电池反应之间的电压差,通过相反符号的施加电位,调节电流,用灵敏的电流计(或其他合适的装置)测量,获得零通量的条件,零。如果使用静电计,则直接测量半电池反应之间的电压差,通过使用具有非常高输入阻抗的静电计实现零通量的条件。零通量的条件是通过平衡两个半电池反应之间的电压差通过相反符号的施加电位,将用灵敏电流计(或其他合适的装置)测量的电流调节到零来获得的。如果使用静电计,则直接测量半电池反应之间的电压差,通过使用具有非常高输入阻抗的静电计实现零通量的条件。零通量的条件是通过平衡两个半电池反应之间的电压差通过相反符号的施加电位,将用灵敏电流计(或其他合适的装置)测量的电流调节到零来获得的。如果使用静电计,则直接测量半电池反应之间的电压差,通过使用具有非常高输入阻抗的静电计实现零通量的条件。
在任一情况下,测量的电压显示由与两个半电池反应平衡的电子的自由能差异表示的驱动力。该差异称为电极电位差,氧化还原电位差或氧化还原电位差。
因为氧化还原电位差是在零通量条件下(经典热力学的“可逆”条件)测量的,所以它是电化学电池反应的自由能变化的直接量度。电极电位测量由电化学电池的氧化还原反应(参见下文)表示的过程的工作项(D G'= -zF D E)的强度因子(D E,以伏特为单位测量)。在电位测量的情况下,可以清楚地看到这一点,因为电位计提供的电压通过外部工作从周围环境中的状态变化(电位计)平衡电极电位差。
参比电极
实际上,相对于标准电极测量氧化还原电位差。通常使用几种电极。的 标准电极为氢半电池,与反应
H 2(气体)==> 2H + + 2e -
其中所有组分都处于其标准状态(气体压力为1个大气压,质子为1M活性,或pH值为0)。这不是一种方便的处理装置,因此更常使用二级标准参比电极,甘汞电极或Ag / AgCl电极。后者具有相对于标准H 2 -电极的氧化还原电位,其被充分表征。通常假定一对的氧化还原电位是相对于标准参比电极(氢电极)的值。如果相对于二级标准测量值,则将相对于标准的二级参考电极电位加到该值。
氧化还原反应的自由能变化
我们将考虑氧化还原反应
A - + B <===> A + B -
其中两个半电池反应是上图中的那些。我们将假设B / B -夫妇是一个标准的参比电极。
让我们考虑一对A / A的半电池反应
A - ==> A + e - --------(1)
并且假设在活动[A]和[A - ],相对于参考半电池测量E伏的电极电位。如果浓度变为[A']和[A' - ],则测量E'伏特的不同电极电位。在测量条件(零通量)下,方程式的反应。在每种情况下,图1中的电极的自由能由电极电位测量。
化学自由能A - =化学自由能A +电自由能e -
或更简洁(和重新安排的术语)
μ 甲 - μ A- - ZFE = 0 =μ ' 甲 - μ' A- - ZFE”
这里z是反应中涉及的电子数(在这种情况下为1),F是法拉第常数。(E的符号是负的,因为电子带负电荷。)
从化学势和浓度之间的关系代替,我们得到
zFE - zFE'= RT ln A / A - - RT ln A'/ A' -让我们假设活动A'和A' -是1M,即标准状态。然后
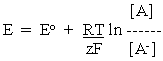
其中E o是在标准状态下测量的电位,或标准的氧化还原电位。
等式2是定义氧化还原电位(电极电位)与氧化还原电对(或半电池反应物)浓度之间关系的最简单形式。
氧化还原电位法的实际应用
在上面的例子中,我们考虑了一种非常简单的氧化还原反应,仅涉及电子转移。在新陈代谢中,我们有更复杂的反应。请考虑Krebs循环中的以下示例:
苹果酸+ NAD + <==>草酰乙酸+ NADH + H +在这里,我们有电子和H的转移,两个半电池反应由下式给出:
苹果酸==>草酰乙酸+ 2H + + 2e -和NADH ==> NAD + + H + + 2e -让我们考虑一下简单的一般情况,用半电池反应来表示:
AH ==> A + H + + e -在应用eq。在上面的图2中,我们认识到半电池反应具有另外的组分H +。遵循相同的逻辑,我们注意到在对数项中,我们必须在比率的最高项中包括半电池反应方程的氧化侧的所有组分,并且在底部的还原侧上包括所有组分。
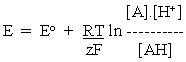 --------(3)
--------(3)
将其应用于上述半电池反应,我们得到:
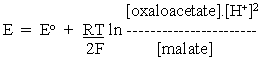
由于我们想比较电极(氧化还原)电位以了解氧化还原系统的相对还原能力,因此在这些方程式中出现的H +是一个不方便的术语(见上文),因为大多数生物化学系统在中性附近运行pH值,而不是使用E o时暗示的1M 。遵循我们在使D G方程更“有用”时应用的相同逻辑,我们将能量贡献从H +浓度转移到标准潜在项。对于一般情况,eq。3成为:
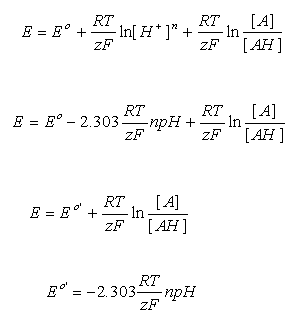
其中z =电子数,n =质子数,参与整个反应。
将其应用于上述苹果酸氧化的半电池反应,并考虑到质子的化学计量,我们得到:
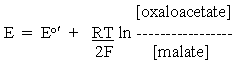
和
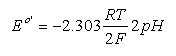
用于OAA /苹果酸半细胞反应,和
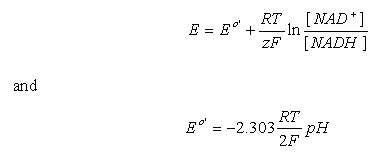
用于NAD + / NADH半细胞反应。
测量氧化还原半电池反应中涉及的电子和质子(H +)的数量
对于一般情况:
AH n ===> A (nz) + nH + + ze -
上面开发的方程可用于查找氧化还原半电池反应中涉及的电子和质子的数量,如下所示:
要找到所涉及的电子数量:
随着氧化组分和还原组分的浓度比的变化,测量半电池的电极电位。绘制ln([氧化组分] / [还原组分])对E; 截距(当[氧化成分] = [还原成分]时,或当所有成分都处于标准状态时,因此比率= 1)得到E o ',斜率给出
由于R和F是常数,因此可以从其获得z的RT
zF
,并且可以测量T.
要找到所涉及的质子数量:
测量E o '作为pH的函数,并绘制结果。在pH 0处的截距给出E o,并且斜率给出
![]()
如果z是已知的,则可以从中计算质子数n。由于2.303 RT / F在25 o C时的值为59.19 ,对于AH + / AH对,n = 1且z = 1,斜率约为。-60 mV / pH单位; 对于夫妻草酰乙酸.2H + /苹果酸,n = 2和z = 2,斜率也将是约。-60 mV / pH单位; 对于NAD + .H + / NADH,n = 1且z = 2,斜率约为。-30 mV / pH单位。
关于公约的说明
在上面的等式中,E已被用于表示测量的电池的电极电位。其他惯例是将测量的电位表示为E'或E h。在比较电极电位和自由能时,使用E'很方便(见下文)。
标准电极电位E o通常称为E m,其中m表示中点。使用该术语是因为当半电池的反应物处于氧化和还原之间的中点(当[氧化组分] = [还原组分]时)或氧化还原滴定的中点时,电极电位具有标准值。 。对于涉及质子的半电池反应,通常使用中点电位E m,pH = nn.nn代替E o ',其中E m值适当的pH值表示为nn.nn. 术语E h,E m,pH = nn.nn和E m通常用作一种惯例,术语E',E o'和E o,作为另一种惯例。
电极电位与反应自由能之间的关系
电化学电池的完全反应可以像任何其他反应一样使用前面几页中给出的D G' 的等式来处理。由于对数比中的活动项与上述E方程中的活动项相同,因此在方程之间替换以找到E和D G 之间的关系是一种简单的练习。这给出了以下关系:
D G'= -zF D E'
D G o = -zF D E o
D G o '= -zF D E o '